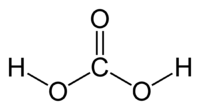
Kyselina uhličitá
Kyselina uhličitá je nestálá anorganická chemická sloučenina (jedna z mála sloučenin, které obsahují v molekule jak uhlík, tak i vodík a přesto jsou anorganické, mezi ně patří také její soli, konkrétně hydrogenuhličitany) existující jen ve formě svého málo koncentrovaného vodného roztoku. Připravuje se zaváděním oxidu uhličitého do vody, který se přitom zčásti (asi z 0,003 %) slučuje s vodou na kyselinu uhličitou:
- CO2 + H2O ↔ H2CO3.
Tato reakce je vratná a její rovnováha se dá snadno ovlivnit teplotou (s rostoucí teplotou klesá tvorba kyseliny uhličité), nebo parciálním tlakem oxidu uhličitého nad roztokem (při otevření láhve s vodou sycenou oxidem uhličitým se kyselina rozkládá a plynný oxid uhličitý v bublinkách uniká). Poslední teoretické výpočty však ukázaly, že za absolutní nepřítomnosti molekul vody jsou samostatné molekuly H2CO3 velmi stabilní, s poločasem rozpadu přibližně 180 000 let.
V přírodě je kyselina uhličitá stálou složkou dešťových srážek a přírodní vody všeobecně. Je příčinou vzniku přechodné tvrdosti vody, tím, že rozpouští uhličitanové minerály obsahující vápník a hořčík; stejný mechanismus je i podstatou vzniku krasových útvarů ve vápencovýchhorninách. Vyšší obsah oxidu uhličitého a tím i kyseliny uhličité mají některé minerální vody. V živočišných organismech je významným meziproduktem v procesech výměny oxidu uhličitého mezi buňkami a krví.
Kyselina uhličitá je velmi slabá dvojsytná kyselina, která se jen částečně disociuje do prvního a ještě méně do druhého stupně:
- H2CO3 ↔ H+ + HCO3– ↔ 2H+ + CO32-
Tvoří dva typy solí uhličitany a hydrogenuhličitany (starší název kyselé uhličitany). Stálé hydrogenuhličitany tvoří pouze alkalické kovy a amonia. Hydrogenuhličitany kovů alkalických zemin existují jen ve vodných roztocích a jsou podstatou přechodné tvrdosti vody; zahřátím roztoku k bodu varu se rozkládají, např.:
- Ca(HCO3)2 → CaCO3 + H2O + CO2.
Všechny uhličitany jsou iontové sloučeniny.
Mezi významné uhličitany a hydrogenuhličitany patří zejména:
- uhličitan sodný (bezvodá soda, Na2CO3);
- uhličitan sodný, dekahydrát (soda, Na2CO3 . 10H2O);
- hydrogenuhličitan sodný (jedlá soda, NaHCO3)
- uhličitan draselný (potaš, K2CO3);
- uhličitan amonný (cukrářské kvasnice, (NH4)2CO3);
- hydrogenuhličitan amonný (NH4HCO3).
Některé uhličitany jsou také známé minerály:
- uhličitan vápenatý (kalcit, jako hornina vápenec a mramor, CaCO3);
- uhličitan hořečnatý (magnezit, MgCO3);
- uhličitan hořečnatovápenatý (dolomit, CaMg(CO3)2);
- uhličitan zinečnatý (smithsonit, ZnCO3);
- uhličitan-dihydroxid diměďnatý (malachit, CuCO3 . Cu(OH)2);
- diuhličitan-dihydroxid triměďnatý (azurit, 2CuCO3 . Cu(OH)2);
- uhličitan železnatý (siderit čili ocelek, FeCO3).