Bromid fosforitý
Bromid fosforitý je anorganická sloučenina se vzorcem PBr3, jeden z bromidů fosforu. Za běžných podmínek se jedná o bezbarvou kapalinu, která na vzduchu dýmá (protože podléhá hydrolýze vzdušnou vlhkostí) a pronikavě páchne. Široce se používá v laboratoři pro konverzi alkoholů na alkylbromidy.
PBr3 se připravuje působením bromu na červený fosfor. Fosfor musí být v nadbytku, aby se zabránilo tvorbě PBr5:
- P4 + 6 Br2 → 4 PBr3
Bromid fosforitý, podobně jako chlorid a fluorid fosforitý, má vlastnosti jak Lewisovy kyseliny, tak Lewisovy zásady. Například s Lewisovou kyselinou, jako je bromid boritý, tvoří stabilní addukty, kupříkladu Br3B-PBr3. Současně ale může v mnoha reakcích reagovat jako elektrofil či Lewisova kyselina, například s aminy.
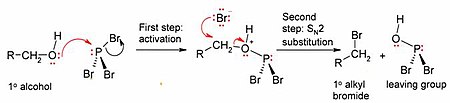
Nejdůležitějšími reakcemi PBr3 jsou ty s alkoholy, kde se hydroxylová skupina nahrazuje atomem bromu a vzniká alkylbromid. Všimněte si, že lze přenést všechny tři atomy bromu.
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
Mechanismus (ukázaný pro primární alkohol) zahrnuje počáteční aktivaci kyslíkového atomu v molekule alkoholu elektrofilním fosforem (čímž vzniká dobrá odstupující skupina) a substituci SN2 na atomu uhlíku.
Vzhledem k substitučnímu kroku SN2 tato reakce obecně dobře funguje pro primární a sekundární alkoholy, ale selhává pro alkoholy terciární. Pokud je reakční uhlíkové centrum chirální, reakce většinou invertuje konfiguraci na alfa uhlíku alkoholu, jak je u reakcí SN2 obvyklé.
Podobnou reakcí PBr3 konvertuje také karboxylové kyseliny na acylbromidy:
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
PBr3 je poměrně silným redukčním činidlem, oxidace PBr3 plynným kyslíkem je mnohem bouřlivější než u PCl3. Reakce probíhá explozivně za vzniku oxidu fosforečného a bromu.